質譜3Q驗證全流程深度解析:從GMP合規到數據可靠性的系統化實踐
發布時間:2025/05/16
點擊次數:156
一、3Q驗證的法規基礎與核心框架
質譜3Q驗證體系源于USP <1058>?和GMP附錄2的強制性要求,其核心是通過IQ(安裝確認)、OQ(運行確認)、PQ(性能確認)三階段驗證,確保質譜數據的可靠性。根據2021版USP <1058>標準,分析儀器被劃分為三類:
- ?A類?:無需驗證(如磁力攪拌器)
- ?B類?:簡化驗證(如pH計)
- ?C類?:完整3Q驗證(質譜儀屬于此類)
驗證過程需遵循生命周期管理模型,從用戶需求規范(URS)開始,貫穿儀器整個使用周期,直至報廢。
二、分階段驗證技術要點解析
1. 安裝確認(IQ)關鍵控制點
| ?項目? | ?技術要求? | ?合規依據? |
|---|---|---|
| 環境條件 | 溫度20±2℃,濕度45-65%RH | GMP附錄2 |
| 氣源系統 | 氦氣純度≥99.999%,壓力波動<0.5psi | ISO 8573-1:2025 |
| 文件完整性 | 含廠商資質、校準證書等12類文件 | USP <1058> 4.2條款 |
需特別檢查渦輪泵真空度?(應<5×10??Torr)和離子源安裝精度?(偏差≤0.1mm)。
2. 運行確認(OQ)性能測試
- ?質量準確性?:采用PFTBA標準品,m/z 502分辨率需>2000
- ?靈敏度驗證?:1pg八氟萘信噪比(S/N)≥100:1
- ?線性動態范圍?:5-6個數量級(R²≥0.995)
- ?碰撞能量穩定性?:CE值波動<±5%(三重四極桿)
測試公式:
R=mΔmR=\frac{m}{Δm}
其中R為分辨率,m為質量數,Δm為半峰寬。
3. 性能確認(PQ)實施策略
- ?已知濃度樣品?:回收率85-115%
- ?未知樣品檢測?:與參考方法偏差<15%
- ?長期穩定性?:連續5天測試RSD<10%
- ?系統適用性測試?:保留時間偏差≤±0.5%
三、特殊場景下的驗證挑戰
-
?二手儀器驗證?
需增加歷史使用評估?:- 電子倍增器計數檢查(<10? counts)
- 四極桿射頻電壓漂移測試(<5%)
- 離子源透鏡污染度評估
-
?計算機化系統驗證?
根據GAMP5要求,需同步執行:- 軟件功能測試(如Analyst軟件)
- 審計追蹤驗證
- 數據完整性檢查(符合ALCOA+原則)
-
?再驗證觸發條件?
- 儀器維修后(涉及真空系統需全驗證)
- 方法變更時(如LC條件改變)
- 年度定期驗證
四、常見失效模式與解決方案
-
?質量軸漂移?
?根本原因?:四極桿溫度波動
?解決方案?:預熱24小時+環境溫度控制 -
?靈敏度下降?
?診斷流程?: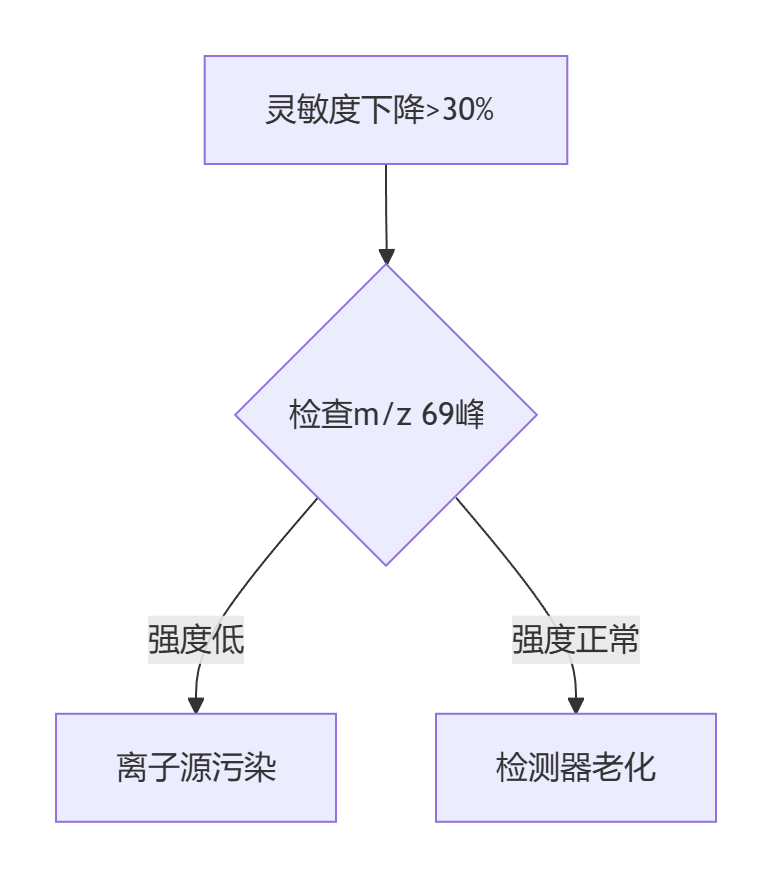
-
?數據合規風險?
通過電子簽名+時間戳確保符合21 CFR Part11,原始數據需保留至產品有效期后1年。
質譜3Q驗證是確保數據可靠性的系統工程,需結合風險評估?(FMEA方法)和生命周期管理,在2025版GMP要求下,建議采用模塊化驗證策略,將傳統6個月驗證周期縮短至4周,同時降低30%驗證成本。對于關鍵制藥應用,必須執行完整驗證流程,并保留所有原始記錄備查。

